Antes de aprender como fazer a distribuição eletrônica de qualquer átomo neutro ou íon, é preciso entender a constituição básica dos átomos e a lógica envolvida na distribuição dos elétrons. Conheça a seguir os conceitos de camadas eletrônicas, níveis e subníveis energéticos. Depois, aprenda a fazer distribuição eletrônica utilizando o diagrama de Linus Pauling e a apresentá-la em ordem energética e ordem geométrica de subníveis. Aprenda também a identificar o subnível mais externo e o mais energético e descubra a relação que existe entre a distribuição eletrônica e os períodos da Tabela Periódica.
Camadas eletrônicas
Os átomos são formados por um núcleo e uma eletrosfera. O núcleo é composto de prótons (partículas de carga positiva) e nêutrons (partículas de carga neutra). A eletrosfera é constituída pelos elétrons (partículas de carga negativa) que giram ao redor do núcleo. Acontece que os elétrons se distribuem na eletrosfera em posições diferentes, uns mais perto do núcleo e outros mais afastados, formando as chamadas camadas eletrônicas. Teoricamente há infinitas camadas que poderiam ser ocupadas pelos elétrons, mas experimentalmente observou-se que existem apenas sete. Eles são designadas pelas letras K, L, M, N, O, P e Q, sendo K a primeira camada, a mais próxima do núcleo.
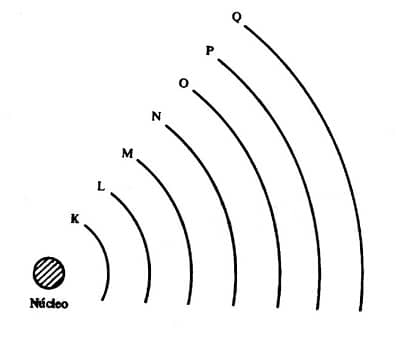
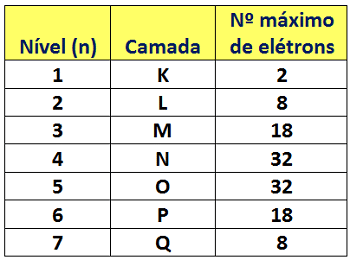
As camadas também podem ser consideradas níveis energéticos, e no próximo tópico você vai entender o porquê. Por enquanto o importante é você saber que quando optamos por usar o termo “níveis”, devemos identificá-los usando os números de 1 a 7, que são chamados de números quânticos principais (n). O número 1 deve ser atribuído ao nível mais próximo do núcleo. Cada nível energético (ou camada) comporta um número máximo de elétrons, conforme mostra a tabela abaixo:
Quanto mais próxima do núcleo está uma camada, maior é a atração que o núcleo exerce sobre os elétrons dela e menos energia potencial esses elétrons possuem. Em compensação, os elétrons das camadas mais afastadas do núcleo são atraídos por ele com intensidade menor, e portanto possuem mais energia potencial. Isso significa que os elétrons mais próximos do núcleo, ou seja, os das camadas mais internas, são mais “presos” a ele, enquanto os elétrons das camadas mais externas são mais “livres”. Para designar esse “grau de liberdade” dos elétrons em relação ao núcleo usa-se o conceito de níveis energéticos.
Níveis e subníveis energéticos
Um nível é mais energético quanto maior for a energia potencial dos elétrons nele contidos. Em outras palavras, um nível é mais energético quanto mais afastado ele estiver do núcleo. Observe a representação da eletrosfera no tópico anterior. Se sabemos que o nível menos energético de todos é o 1 (correspondente à camada K, mais perto do núcleo) e o mais energético é o 7 (correspondente à camada Q, mais distante do núcleo), podemos concluir que a energia potencial dos elétrons é crescente do nível mais interno para o nível mais externo da eletrosfera. Essa regra é válida mesmo para os átomos que possuem menos de sete camadas.
A quantidade total de níveis que uma eletrosfera possui é determinada pela quantidade de elétrons do átomo. Os elétrons vão sendo distribuídos conforme a capacidade máxima de cada nível, começando pelo nível 1 (camada K) e prosseguindo até que todos os elétrons estejam acomodados. O hidrogênio, por exemplo, possui apenas um nível energético, porque só precisa acomodar um elétron. Já o ferro apresenta quatro níveis em sua eletrosfera, nas quais estão distribuídos 26 elétrons. O urânio, por sua vez, possui sete níveis para comportar seus 92 elétrons.
Mas a distribuição eletrônica não é feita somente em função dos níveis energéticos. Dentro dos níveis, os elétrons apresentam quantidades de energia características. Cada uma dessas quantidades corresponde a uma subdivisão do nível, dando origem aos chamados subníveis energéticos. Eles são quatro, designados pelas letras minúsculas s, p, d, f. Assim como os níveis, os subníveis apresentam números quânticos que indicam a energia do elétron dentro deles. São os chamados números quânticos secundários ou azimutais (ℓ). Respectivamente, os subníveis s, p, d, f apresentam números quânticos secundários 0, 1, 2 e 3. Também de maneira semelhante aos níveis, cada subnível comporta uma quantidade máxima de elétrons.
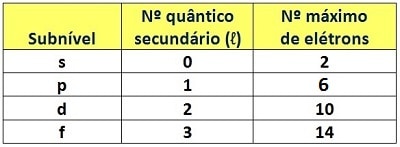
A distribuição eletrônica nos subníveis é feita preenchendo-se totalmente um subnível antes de passar para o próximo. Acontece que a ocupação dos subníveis não obedece os limites dos níveis. Os elétrons não vão se acomodando nos subníveis de um mesmo nível até preenchê-lo, eles seguem uma ordem diferente, a ordem crescente de energia. O químico norte-americano Linus Pauling elaborou um diagrama que permite fazer a distribuição eletrônica segundo essa ordem crescente. O dispositivo ficou conhecido como diagrama de Linus Pauling.
Distribuição eletrônica segundo o diagrama de Linus Pauling
Observe o diagrama de Linus Pauling. De cima para baixo, ele traz os níveis de energia em ordem crescente, representados pelos números de 1 a 7. Os subníveis que cada nível possui são representados pelas letras s, p, d, f. À direita de cada letra, um número sobrescrito indica a quantidade máxima de elétrons que o subnível comporta. As setas indicam o sentido em que o diagrama deve ser lido. Cada seta deve ser percorrida até o fim, para só então passarmos para o início da próxima.
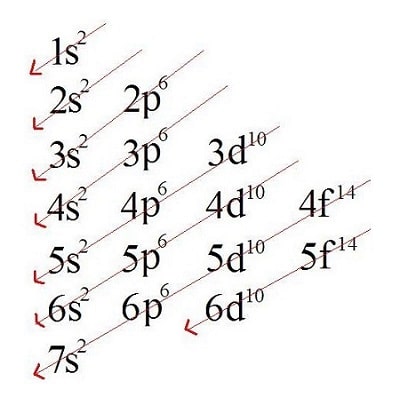
A leitura do diagrama nos fornece a ordem crescente dos subníveis de energia, que é a seguinte:
1s2 – 2s2 – 2p6 – 3s2 – 3p6 – 4s2 – 3d10 – 4p6 – 5s2 – 4d10 – 5p6 – 6s2 – 4f14 – 5d10 – 6p6 – 7s2 – 5f14 – 6d10 – 7p6
Essa é a ordem em que os elétrons se acomodam nos subníveis de energia. Para fazer a distribuição eletrônica, precisamos obedecer a essa ordem e observar o número máximo de elétrons que cada subnível comporta. A distribuição é feita preenchendo-se cada subnível antes de passar para o próximo. Se no último subnível houver menos elétrons que a capacidade máxima dele, não tem problema. Nesse caso, o número que acompanha a letra deve ser substituído pelo número de elétrons.
Vejamos o exemplo da distribuição eletrônica do átomo neutro de ferro, que possui 26 elétrons. Segundo a ordem das setas, a distribuição é a seguinte: 1s2 – 2s2 – 2p6 – 3s2 – 3p6 – 4s2 – 3d6. Note que o subnível 3d, o último a ser preenchido, tem capacidade para até 10 elétrons, mas só havia 6 para serem alocados nele.
Subníveis em ordem energética e em ordem geométrica
No exemplo da distribuição do átomo de ferro, perceba que quando escrevemos a sequência de subníveis segundo as diagonais do diagrama, escrevemos exatamente na ordem crescente de energia: 1s2 – 2s2 – 2p6 – 3s2 – 3p6 – 4s2 – 3d6. Essa é a chamada ordem energética.
A outra forma de representar a distribuição eletrônica por subníveis de energia é a a ordem geométrica. Nela, após fazer a distribuição conforme a ordem energética, agrupamos os subníveis de cada nível. No caso átomo neutro de ferro, a ordem geométrica fica assim: 1s2 – 2s2 2p6 – 3s2 3p6 3d6 – 4s2.
Subnível mais energético e subnível mais externo
A ordem energética nos permite identificar o subnível mais energético, que é sempre o último da sequência. No caso do ferro, é o subnível 3d6. Já a ordem geométrica mostra o subnível mais externo, que também é sempre o último. O subnível mais externo do ferro é o 4s2.
Às vezes o subnível mais energético e o mais externo são o mesmo, mas quando isso acontece trata-se de uma coincidência. É sempre necessário ordenar os subníveis energeticamente para descobrir qual é o mais energético e geometricamente para identificar qual é o mais externo.
Distribuição eletrônica de átomos neutros e de íons
A distribuição eletrônica de átomos neutros é feita considerando-se o número de elétrons que o átomo do elemento possui em seu estado fundamental, que é igual ao seu número de prótons ou número atômico (Z). Por isso quando demos o exemplo da distribuição eletrônica do átomo neutro de ferro (Z=26) distribuímos 26 elétrons.
O caso da distribuição eletrônica de íons não é complicado. Um íon nada mais é que um átomo que ganhou ou perdeu elétrons do seu nível mais externo (último nível). Um íon que resulta do ganho de elétrons é chamado de ânion e o que é formado pela perda de elétrons é chamado de cátion. A forma mais fácil de fazer a distribuição eletrônica de um íon é fazer primeiro a distribuição do seu átomo neutro, ordenar os subníveis geometricamente e depois retirar ou adicionar os elétrons do último nível.
Veja o exemplo da distribuição do cátion de ferro Fe+2. Trata-se de um átomo de ferro que perdeu 2 elétrons de seu último nível.
Distribuição do átomo de ferro neutro (Z=26):
Ordem energética: 1s2 – 2s2 – 2p6 – 3s2 – 3p6 – 4s2 – 3d6
Ordem geométrica: 1s2 – 2s2 2p6 – 3s2 3p6 3d6 – 4s2
Identificamos o nível mais externo, que é o 4. Ele possui apenas um subnível, o s2. Precisamos retirar dois elétrons do último nível, e eles sairão justamente do único subnível que esse nível possui. Já que é assim, o subnível 4s2 vai deixar de existir, e a distribuição do Fe+2 fica desse jeito:
Distribuição do cátion Fe+2:
Ordem geométrica: 1s2 – 2s2 2p6 – 3s2 3p6 3d6
Ordem energética: 1s2 – 2s2 – 2p6 – 3s2 – 3p6 3d6
Distribuição eletrônica na Tabela Periódica
Existe uma relação entre os períodos da Tabela Periódica e os níveis energéticos que os elementos apresentam. Note que a Tabela possui sete períodos, numerados de cima para baixo. O número de cada um deles corresponde à quantidade de níveis (ou camadas) que seus elementos apresentam. Assim, os elementos do primeiro período, hidrogênio e hélio, apresentam apenas um nível energético, enquanto os do segundo período possuem dois níveis, e assim por diante, até o sétimo período.