
O potássio é um elemento químico do grupo 1 (metais alcalinos) que pertence ao quarto período da tabela periódica.
O potássio é um metal, excelente condutor de eletricidade, mole e altamente reativo. Possui na camada eletrônica mais externa um elétron fracamente ligado ao núcleo e geralmente forma compostos univalentes, iônicos e incolores. Os hidróxidos e óxidos são bases muito fortes e os oxo-sais são muito estáveis.
O potássio junto com o sódio constitui cerca de 4% em peso da crosta terrestre. Seus compostos são muito comuns, sendo conhecidos e usados desde os primórdios da civilização.
Estrutura eletrônica
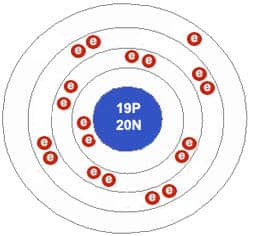
O potássio tem um elétron de valência livre no orbital mais externo- um elétron, que ocupa um orbital esférico. Ignorando-se as camadas eletrônicas internas preenchidas, suas configurações eletrônicas podem ser escritas como: 4s1. O elétron de valência encontra-se bastante afastado do núcleo.
Tamanho dos átomos e íons
O potássio é um átomo de tamanho moderado relacionado aos outros elementos do seu grupo.
O potássio é miscível com os outros metais alcalinos em todas as proporções.
Densidade
Por ser de tamanho moderado apresenta densidade baixa. O potássio é pouco menos denso que a água.
Eletronegatividade e tipos de ligação
A eletronegatividade do potássio é relativamente muito pequena. Assim, quando ele reage com outros elementos para formar compostos, geralmente existe uma grande diferença de eletronegatividade entre eles, com a conseqüente formação de ligações iônicas.
Estrutura Cristalina dos Metais, dureza e energia de coesão.
O potássio é um metal muito mole e pode ser cortados facilmente.
O potássio possui somente um elétrons de valência que pode participar das ligações (comparado com dois ou mais elétrons na maioria dos outros metais. Esse fato, associado ao grande tamanho dos átomos e à natureza difusa do elétron externo, é responsável pela baixa energia de coesão, pequena força de ligação e baixa resistência mecânica dos metais alcalinos.
Ponto de Fusão e de Ebulição
As baixas e energias de coesão potássio se reflete nos valores muito baixos das temperaturas de fusão e de ebulição dos elemento.
Propriedades químicas
– Reação com a água
O potássio reage com a água, liberando hidrogênio e formando os correspondentes hidróxidos. O potássio funde e sempre inflama.
2K + 2H2O → 2KOH + H2
– Reação com o ar
O potássio é quimicamente muito reativo, e rapidamente perde o brilho quando expostos ao ar seco. O potássio forma óxidos de vários tipos.
– Reação com o nitrogênio
Não reage diretamente com o nitrogênio.
Solubilidade
Todos os sais simples se dissolvem em água, formando íons; e portando essas soluções conduzem corrente elétrica.
O potássio possui uma boa solubilidade em água.
Importância Biológica
Os organismos vivos requerem pelo menos 27 elementos, 15 dos quais são metais. Os metais essenciais presentes em maior quantidade são K, Mg, Na e Ca.
Em vista da grande semelhança das propriedades químicas do Na e K, suas funções biológicas são diferentes. O Na+ é ativamente expulso das células, mas p K+. Esse transporte de íons é denominado “bomba de sódio”, e envolve tanto a expulsão ativa de Na+ como a captura ativa de K+. As análises dos fluidos externos e internos à célula indicam que o transporte de íons realmente ocorre.
A diferença de concentração entre Na+ e K+ dentro e fora da célula produz uma diferença de potencial elétrico através da membrana celular, essencial para funcionamento de células nervosas e musculares.