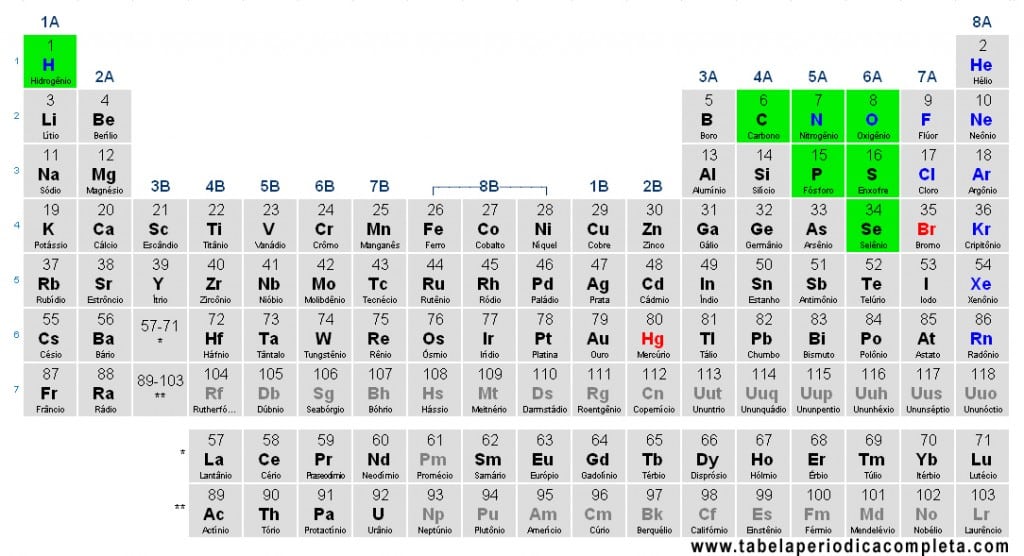
Os Não-Metais (ou Ametais) são elementos químicos com alta eletronegatividade e tendência a ganhar ou compartilhar elétrons, formando principalmente ligações covalentes. Na Tabela Periódica, localizam-se majoritariamente no canto superior direito. A exceção de posição é o Hidrogênio (H), que aparece no topo da coluna dos alcalinos, mas, pelo comportamento químico, é classificado como não-metal.
Quais elementos são Não-Metais?
Em termos didáticos, incluem-se como não-metais os elementos abaixo (agrupados por famílias usuais):
- Hidrogênio (H)
- Grupo 14 (carbonoides – não metálicos): Carbono (C)
- Grupo 15 (pnictogênios – não metálicos): Nitrogênio (N), Fósforo (P)
- Grupo 16 (calcogênios – não metálicos): Oxigênio (O), Enxofre (S), Selênio (Se)
- Halogênios (grupo 17): Flúor (F), Cloro (Cl), Bromo (Br), Iodo (I) (o astato, At, é halogênio radioativo de comportamento menos conhecido e por vezes tratado à parte)
- Gases Nobres (grupo 18): Hélio (He), Neônio (Ne), Argônio (Ar), Criptônio (Kr), Xenônio (Xe), Radônio (Rn) (e o superpesado oganessônio, Og, sem aplicações por instabilidade)
Observação: algumas tabelas antigas listavam “apenas sete” ametais (C, N, O, P, S, Se e H), mas a classificação moderna considera também halogênios e gases nobres como não-metais.
Propriedades gerais dos Não-Metais
- Eletronegatividade e afinidade eletrônica elevadas em comparação com metais; tendem a formar ânions (em compostos iônicos) ou compartilhar elétrons (em compostos covalentes).
- Condução: em geral, maus condutores de eletricidade e calor. Exceções estruturais como a grafite (C) conduzem eletricidade no plano das camadas.
- Estados físicos a 25 °C: podem ser gases (H₂, N₂, O₂, F₂, Cl₂ e gases nobres), líquidos (Br₂) ou sólidos (C, P, S, Se, I).
- Alotropia frequente: Carbono (diamante, grafite, grafeno, fulerenos), Fósforo (branco, vermelho, negro), Enxofre (rômbico, monoclínico).
- Óxidos predominantemente ácidos (p.ex., CO₂, SO₃, P₂O₅); há exemplos neutros (CO, N₂O) e anidridos ácidos que geram oxoácidos em água.
Ligações químicas e tipos de substância
- Moleculares: muitas espécies existem como moléculas discretas (O₂, N₂, Cl₂, H₂O, NH₃, CO₂).
- Redes covalentes: sólidos com alto ponto de fusão e dureza, como diamante (C) e formas de sílica (SiO₂; o Si é um semimetal que forma redes com oxigênio).
- Compostos iônicos: formados ao reagirem com metais (p.ex., NaCl, Ca₃(PO₄)₂), onde o não-metal costuma atuar como ânion.
Reatividade e tendências periódicas
- Reatividade com metais: formam sais iônicos (haletos, sulfetos, oxossais).
- Entre si: geram compostos covalentes de grande diversidade (ácidos, bases de Lewis, oxoácidos, hidretos, óxidos).
- Tendências: a eletronegatividade e a energia de ionização aumentam da esquerda para a direita e de baixo para cima; o raio atômico diminui no mesmo sentido.
Importância biológica e ambiental
- Constituição da vida: biomoléculas essenciais (proteínas, lipídios, carboidratos, ácidos nucleicos) são ricas em C, H, O, N, P e S.
- Ciclos biogeoquímicos: ciclo do carbono, ciclo do nitrogênio, ciclo do oxigênio e ciclo do fósforo regulam clima, fertilidade do solo e ecossistemas.
- Atmosfera: N₂ e O₂ dominam o ar; gases nobres são traços estáveis; ozônio (O₃) protege contra UV.
Aplicações e exemplos práticos
- Carbono: materiais avançados (grafeno, nanotubos), filtros, eletrodos, polímeros (via petroquímica).
- Nitrogênio: produção de amônia (Haber-Bosch) para fertilizantes; atmosfera inerte em processos industriais.
- Oxigênio: suporte à combustão e à respiração; siderurgia e processos oxidativos.
- Fósforo: fertilizantes (fosfatos), detergentes controlados, ligas de fósforo vermelho.
- Enxofre: ácido sulfúrico, vulcanização da borracha, fármacos e agroquímicos.
- Halogênios: desinfecção de água (Cl₂/hipoclorito), farmacêuticos e materiais halogenados.
- Gases nobres: iluminação (Ne, Ar, Xe), argônio como gás de proteção em soldagem, hélio criogênico.
Mitos comuns e correções
- “Apenas sete não-metais”: incorreto para a classificação moderna; incluem-se também halogênios e gases nobres.
- “Todos isolantes”: em geral sim, mas há exceções estruturais (grafite) e condições específicas (dopagem, pressão).
- “Óxidos sempre ácidos”: a maioria é ácida, porém existem óxidos neutros (CO, NO) e casos anfóteros em contextos específicos.
FAQ – Perguntas Frequentes sobre Não-Metais
Quais são os principais Não-Metais?
Didaticamente: H, C, N, O, P, S, Se, além dos halogênios (F, Cl, Br, I) e dos gases nobres (He, Ne, Ar, Kr, Xe, Rn).
Por que o Hidrogênio é não-metal se está com os alcalinos?
Por tradição de organização da tabela (ns¹), ele figura no grupo 1, mas suas propriedades químicas (formação de H₂, ligações covalentes, acidez) são típicas de não-metal.
Os não-metais conduzem eletricidade?
Em geral, não. Exceções: a grafite (alótropo do carbono) conduz nos planos; materiais não metálicos podem conduzir se dopados ou em condições especiais.
Os óxidos de não-metais são sempre ácidos?
A maioria sim (p.ex., SO₃ → H₂SO₄; P₂O₅ → H₃PO₄), mas existem neutros (CO, NO) e particularidades conforme estrutura e estado de oxidação.
Quais são os usos mais comuns de não-metais?
Fertilizantes (N, P), tratamento de água (Cl), polímeros (C, H, Cl, F), eletrônica e iluminação (gases nobres), oxidação e respiração (O₂).
Não-metais são maioria na Terra?
Em número de elementos, metais são mais numerosos; porém, não-metais dominam a composição da biosfera e da atmosfera (C, H, O, N) e formam a base da química da vida.