
Os elementos do grupo 16 são conhecidos como calcogênios. O termo deriva da junção de duas palavras gregas, “Khalkos” (cobre) e “genos” (origem), e significa “originário do cobre”. Apesar de o cobre sequer fazer parte do grupo 16, o grupo é chamado assim porque dois de seus elementos, o oxigênio e o enxofre, estão sempre presentes nos minérios de cobre.
O oxigênio é um elemento muito importante na química inorgânica, visto que reage com quase todos os demais elementos. Ele apresenta diversas diferenças em relação aos demais elementos do grupo 16. Essas diferenças estão relacionadas ao seu menor tamanho, sua maior eletronegatividade e à falta de orbitais d adequados para formar ligações. O oxigênio pode utilizar orbitais hibridizados pπ para formar ligações duplas. Também forma ligações fortes com o hidrogênio, o que influencia enormemente as propriedades da água e de outros compostos.
Praticamente todos os elementos reagem com o oxigênio à temperatura ambiente ou por aquecimento (as únicas exceções são alguns poucos metais nobres, como platina, ouro e tungstênio, e os gases nobres). Mesmo com a energia de ligação do O2 sendo alta (493 kJ/mol), as reações geralmente são bastante exotérmicas e, umas vez iniciadas, prosseguem espontaneamente.
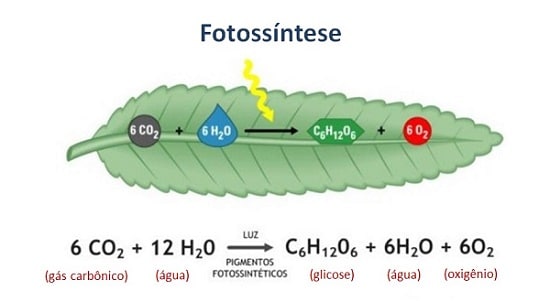
O oxigênio é essencial à respiração celular e à fotossíntese. É, portanto, essencial à vida. O complexo formado pelo oxigênio e a hemoglobina (o pigmento vermelho do sangue) é de importância vital. Esse é o método pelo qual os animais superiores transportam o oxigênio para as células de todo o corpo.

A produção mundial de oxigênio líquido e gasoso é de cerca de 100 milhões de toneladas por ano. De longe, os maiores consumidores de oxigênio são as indústrias do ferro e do aço, que utilizam, respectivamente, 60% e 80% da produção. O oxigênio puro é usado para converter o ferro-gusa em aço, no processo básico que se originou dos processos Kaldo e LD (Linz-Donawitz). Desde o fim da década de 50, esses processos substituíram o processo Bessemer, que usava ar. Usinas para a produção de oxigênio frequentemente estão instaladas nas vizinhanças de modernas usinas siderúrgicas, ou até mesmo fazem parte das instalações delas. O O2 é conduzido através de tubulações de uma usina a outra. Os modernos métodos que utilizam O2 apresentam três vantagens:
- A conversão do ferro-gusa em aço é mais rápida;
- Lingotes maiores de ferro-gusa podem ser utilizados;
- Nitretos não são formados durante o processo. Eles podem ser formados se for utilizado o ar.
Em alguns lugares, o oxigênio é introduzido junto com o ar nos altos-fornos – usados para a redução de óxidos de ferro a ferro-gusa impuro – com coque (tipo de combustível derivado do carvão betuminoso). Esse procedimento é adotado principalmente para permitir o emprego de hidrocarbonetos pesados (nafta) como combustíveis, como um substituto parcial do coque metalúrgico, que é caro. O oxigênio também é utilizado na solda e no corte de metais com o maçarico oxiacetilênico (maçarico industrial). Entre outras importantes aplicações químicas do oxigênio, estão as seguintes:
- Usado na obtenção de TiO2 a partir de TiCl4. O Ti2 é usado como pigmento branco em tintas e papéis, e como carga em plásticos;
- Usado para oxidar NH3 no processo de obtenção do HNO3;
- Empregado na preparação de oxirano (óxido de etileno) a partir de eteno;
- Usado como agente oxidante (comburente) em foguetes.
Alotropia do oxigênio
O oxigênio ocorre em duas formas alotrópicas: dioxigênio e ozônio. O dioxigênio, O2, é uma molécula diatômica estável, o que explica sua existência na forma de um gás. O ozônio, O3, é a variedade alotrópica triatômica do oxigênio. Ele é instável e se decompõe a O2. Sua estrutura é angular, com um ângulo de ligação de 116°48’.