
O carbono é onipresente na natureza. É um constituinte essencial de toda a matéria viva, como proteínas, carboidratos e gorduras. A Química Orgânica se dedica ao estudo da química dos compostos de carbono. O dióxido de carbono é fundamental na fotossíntese e é liberado na respiração. Compostos de carbono produzidos em larga escala incluem o negro fumo, coque, grafita, carbonatos, dióxido de carbono, monóxido de carbono (como gás combustível), uréia, carbeto de cálcio, cianamida de cálcio e dissulfeto de carbono. Há um grande interesse em torno de compostos organometálicos, carbonilas e complexos com ligações π.
O carvão ativado é fabricado aquecendo-se ou oxidando-se quimicamente a serragem ou a turfa. O carvão ativado tem uma enorme área superficial, sendo usado para alvejar o açúcar e muitos produtos químicos. É também usado como absorvedor de gases venenosos em máscaras contra gases, como filtro no tratamento de águas residuais e como catalisador em algumas reações.
O negro de fumo (fuligem) é empregado na indústria da borracha, mais especificamente na fabricação de pneus. Outro uso importante é na obtenção de tintas para impressão.
O coque é de grande importância na metalurgia do ferro e de muitos outros metais. A destilação do carvão também constitui uma importante fonte de compostos orgânicos.
O diamante também é constituído de carbono. Os diamantes maiores são lapidados para jóias e seu tamanho é medido em quilates (1g = 5 quilates). Cerca de 30% da produção é utilizada em joalherias e 70% para fins industriais diversos, principalmente na fabricação de brocas ou abrasivos para corte e polimento, pois o diamante é muito duro. É economicamente viável produzir sinteticamente pequenos diamantes de qualidade industrial, tratando-se a grafita a altas temperaturas e pressões.
Estrutura e alotropia do carbono
O carbono pode existir em diversas formas alotrópicas, que incluem o diamante, α e β-grafite, a rara forma hexagonal do diamante, e várias moléculas discretas tais como C60, que na verdade são clusters de carbono denominados coletivamente de fulerenos.
O grafite é constituído por camadas planas de átomos de carbono. Cada camada é uma rede constituída por malhas hexagonais de carbono, como se fosse uma molécula gigante formada por anéis de benzeno fundidos. Forças fracas de Van der Waals mantêm unidas essas camadas. O grafite pode ser facilmente clivado separando-se as camadas, o que explica a baixa dureza dos seus cristais. O grafite é usado como lubrificante sozinho ou disperso em óleo. Já diamante é duro (10 na escala de Mohd) e usado como abrasivo. O grande espaçamento entre as camadas de grafite também implica que os átomos não ocupem o espaço de maneira muito efetiva. Assim, a densidade do grafite (2,22 g cm3) é menor que a do diamante (3,51 g cm3).
No grafite, apenas três dos elétrons de valência de cada átomo de carbono estão envolvidos na formação das ligações σ (utilizando orbitais híbridos sp2). O quarto elétron forma uma ligação π. Os elétrons π estão deslocalizados por toda a camada e são móveis. Logo, o grafite pode conduzir eletricidade dentro de uma mesma camada, mas não de uma camada para outra.
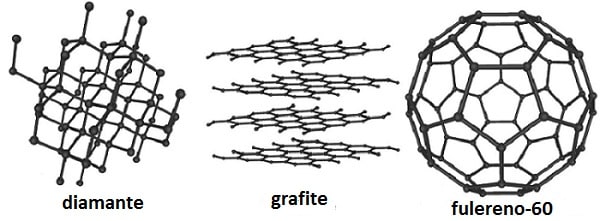
O diamante é extremamente inerte, em contraste com a grafita que é bastante reativa. São incolores, embora os diamantes industriais sejam muitas vezes pretos. A maioria dos diamantes naturais contém pequenas quantidades de nitrogênio, mas os “diamantes azuis” contêm alumínio em vez de nitrogênio. No diamante, cada átomo de carbono está ligado tetraedricamente a quatro outros átomos de carbono, cada um a uma distancia de 1,54 Å. Os tetraedros estão ligados uns aos outros formando uma molécula gigante tridimensional, a célula unitária cúbica. Ligações covalentes fortes se estendem em todas as direções. Por isso diamante é muito duro seu ponto de diamante é elevado (cerca de 3930 °C).
Os fulerenos são extraídos facilmente da mistura de fuligem por dissolução em benzeno ou solventes hidrocarbonetos, produzindo uma solução vermelha de onde é possível obter cristais de coloração mostarda. Os outros compostos podem ser separados por cromatografia. Os fulerenos são compostos covalentes, e por isso são solúveis em solventes orgânicos.
O carbono difere dos outros elementos por sua capacidade única de formar ligações múltiplas pπ-pπ, tais como C=C, C≡C, C=O, C=S e C≡N. O carbono também difere dos demais elementos em sua acentuada capacidade de formar cadeias (catenação). Isso porque as ligações C-C são fortes, e as energias das ligações Si-Si, Ge-Ge e Sn-Sn diminuem progressivamente.
Datação com carbono radioativo
A técnica de datação com carbono radioativo é bastante empregada para determinar a idade de fósseis.
O carbono ocorre essencialmente como o isótopo 12C, mas há uma pequena quantidade do isótopo 13C, o que resulta na massa atômica de 12,011. Esse isótopo de carbono reage com oxigênio, formando 14CO2, e acaba sendo utilizado pelas plantas verdes na fotossíntese, que leva à síntese de glicose. A glicose é utilizada pela planta na síntese de amido, proteínas, celulose e outros materiais constituintes de sua estrutura. Assim, todos os tecidos da planta contêm traços de 14C. Os animais alimentam-se de plantas, e assim também conterão traços de 14C.
Quando um organismo vivo morre, ele deixa de absorver átomos de carbono. No momento da morte, as quantidades de carbono 12 e de carbono 14 presentes no corpo são iguais às de outros organismos que ainda estão vivos, mas ao longo do tempo a taxa de carbono 12 no organismo morto não se altera, enquanto a de carbono 14 vai decaindo. Sabe-se que a meia-vida do carbono 14 é de 5.700 anos. Com esse parâmetro, é possível comparar a taxa de carbono 14 encontrada no organismo morto com a taxa desse isótopo presente em organismos vivos semelhantes a ele, e assim determinar com precisão quanto tempo tem o fóssil analisado.
A fórmula utilizada na datação com carbono 14 é a seguinte:
t = [ ln (Nf/No) / (-0,693) ] x t1/2
Nela, ln é o logaritmo neperiano, Nf/No é a porcentagem de carbono 14 presente na amostra comparada com a taxa desse isótopo encontrada em organismos vivos e t1/2 é a meia-vida do carbono 14 (que é de 5.700 anos).
Propriedades físicas
O carbono apresenta um ponto de fusão extremamente elevado.
O ciclo do carbono

Em contraste, há um ciclo rápido na atmosfera envolvendo CO2, compostos de carbono, organismos vivos e CO2 dissolvido nos oceanos, além de um ciclo mais lento envolvendo os minerais carbonatados formados no fundo dos oceanos. Existe equilíbrio entre eles. A proporção de CO2 na atmosfera é de aproximadamente 0,046% em peso e 0,031% em volume. Embora seja uma percentagem relativamente pequena, corresponde a 2500 bilhões de toneladas, e é essencial à vida.