
O enxofre é moderadamente reativo e queima ao ar, formando dióxidos. Ele se combina diretamente com a maioria dos elementos, tanto metais quanto não-metais, embora com menor facilidade que o oxigênio. Possui maior tendência à formação de cadeias e ciclos (variedades alotrópicas) que os demais elementos de seu grupo. Com o nitrogênio ele forma uma extensa e incomum variedade de compostos que não encontram correspondentes nos demais elementos. O enxofre é um constituinte essencial, embora menos frequente, de certas proteínas. Está presente nos aminoácidos cistina, cisteína e metionina.
Cerca de 60% do H2SO4 produzido é empregado na fabricação de fertilizantes. O restante é utilizado na produção de uma variedade de outros produtos químicos. Sulfitos, hidrogenossulfitos e SO2 são importantes como alvejantes. Os 10% da produção de enxofre que não são consumidos na produção de H2SO4 são empregados na forma de enxofre elementar. Parte é usada na fabricação de dissulfeto de carbono, que por sua vez é usado na fabricação de CCl4 e de viscose. O enxofre reage com alcenos formando importantes ligações cruzadas entre as moléculas. Essa reação é importante no processo de vulcanização da borracha. O enxofre também é utilizado na fabricação de fungicidas, inseticidas e pólvora. A pólvora é composta por 75% de “salitre do Chile”, rico em NaNO3, 15% de carvão vegetal e 10% de enxofre.
Enxofre e chuva ácida
A química atmosférica da chuva ácida não é inteiramente compreendida. SO2 é oxidado a SO3 pelo ozona ou pelo peróxido de hidrogênio, e reage com a água ou com radicais hidroxila para formar H2SO4. Forma-se também sulfato de amônio, que pode ser visto como um “nevoeiro” atmosférico (este pode ser descrito como sendo um aerosol de partículas muito pequenas).
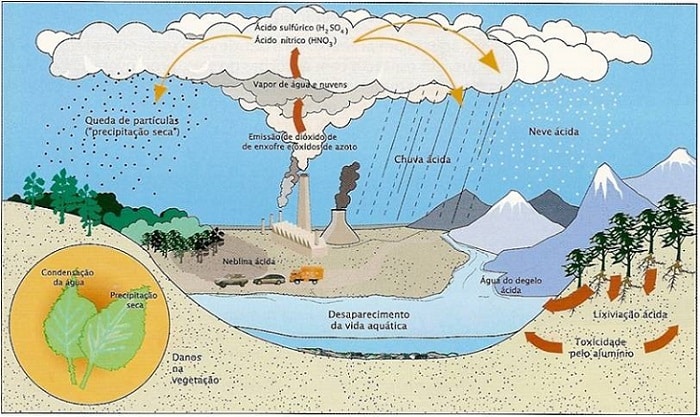
Depois que as gotas de chuva se nuclearam com partículas de aerosol de SO3 ou (NH4)2SO4, ocorre disposição por via úmida, mas o SO2 não se dissolve apreciavelmente. Na realidade, o SO2 é depositado por via seca, ou seja, é absorvido diretamente tanto por sólidos quanto por líquidos que se encontram na superfície da Terra.
Alotropia do enxofre
O enxofre é o elemento que possui a maior variedade de formas alotrópicas, entre elas as moléculas de S2, S4, S6 e S8. Entretanto, os dois alótropos mais comuns do enxofre são o enxofre-α ou rômbico, que é estável a temperatura ambiente, e o enxofre-β ou monoclínico, que é estável acima de 95,5 °C. Ambos possuem a fórmula molecular S8, mas são diferenciados pelo arranjo dos átomos no retículo cristalino.
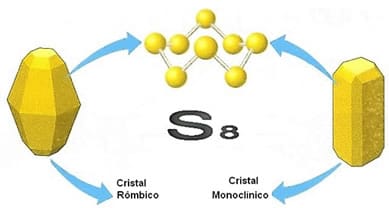
A estrutura cristalina do enxofre rômbico resulta em cristais relativamente transparentes e grandes. Já o enxofre monoclínico é composto de cristais menores, opacos e que apresentam a forma de minúsculas agulhas.